实验一 微量吸管、显微镜、血细胞计数盘的使用
【目的要求】
1、掌握微量微量吸管(血红蛋白吸管)的吸液操作技术;
2、掌握牛-鲍氏计数盘细胞使用及影响因素。
3、熟悉熟悉光学显微镜的原理;
4、熟悉对显微镜如何进行使用与保养;
一、显微镜的使用
【原理】
当被观察物体置于物镜前的焦点稍远处时.物体反射的光线经物镜放大后成一倒立实像位于目镜前焦点附近.再经目镜放大呈倒立虚像位于观察者的明视距离(约250mm)处。
【器材】
光学显微镜、载物片(瑞氏染色血涂片)、擦镜纸。
【试剂】
香柏油、清洁液(乙醇:乙醚:3:7)
【操作】
1.准备 将光学显微镜放置在采光好的实验台上,避免振动。向上转动粗调螺旋至一定高度后,将载物片放于载物台上。
2.调焦与低倍镜观察 将10×低倍物镜对准镜筒,转动粗调螺旋使物镜下降到快接触标本处后,选择平面反光镜的角度,调整聚光器的上下高度和光栅大小,使目视亮度适宜,再用细调螺旋上下调节焦点,使物像清晰。
低倍镜常用于全片浏览,观察标本的总体分布,对骨髓增生程度判定和对尿中管型、粪便中寄生虫等的检验。
3.高倍镜观察 转换40倍物镜对准镜筒,一般不需重新调焦,仅调节细螺旋即可看到清晰物像。
高倍镜常用于血细胞计数、体腔液、排泄物和分泌物的观察。
4.油镜观察 于瑞氏染色血涂片体尾交界处滴加香柏油一小滴,将玻片放在载物台上。使油镜头(100×)对准镜筒,转动粗调螺旋使之降至与玻片轻轻接触。然后升高聚光镜使其与载物台平齐,将光栅放至最大.选择凹面反光镜调节角度,使射入光线最强。再转动粗调螺旋使物镜上升,待见到标本中物像后.调节细调螺旋使物像清晰,对标本进行顺序观察。
油镜最常用于血液、骨髓或脱落细胞标本的形态学观察和分类。
5.收镜 显微镜使用完毕,取下载物片,用擦镜纸将油镜头揩干净(必要时可滴一滴清洁液于擦镜纸上)。用绸布擦拭镜身,将物镜转成“八”字形(勿使物镜与目镜相对),镜筒、聚光器下降至最低处,反光镜放水平位,以右手握镜臂,左手托镜座,轻轻放人显微镜箱内。
[注意事项]
1.要培养良好的操作习惯.工作台与凳子高度要合适,坐姿端正,胸背挺直,两目睁开。单筒镜用左眼观察,双筒镜注意调好瞳距。
2.使用螺旋时要注意,当对焦时以转动粗调螺旋为主,尽量少用细调螺旋,以延长机械系统的寿命。在转换高倍镜,特别是油镜观察时,切记粗调螺旋只能将镜头上移而不能下移,以免压碎载物片,碰坏镜头。
3.香柏油折射率为1.51525,与透镜折射率相近,能提高分辨率,注意用时不宜过多。用后要及时擦去,否则可引起显微镜损坏。如香柏油挥发变浓,可用二甲苯稀释。
4.光学系统清洁,一般情况下可用洗耳球吹气、小毛刷刷除仪器表面的灰尘。当光学系统有污染时,可用擦镜纸蘸清洁液擦拭,如被尿、便等污染时可用棉签蘸1%氨水擦拭污染区。
5.显微镜存放的环镜条件应防震、防潮、防尘、防日晒、防温差过大。
二、微量吸管的使用:
【原理】
挤压乳胶吸头使刻度微量吸管产生负压而吸取液体。
【器材】
一次性微量吸管和带孔乳胶吸头、小号试管、干棉球、2ml吸管或2ml加液瓶
【试剂】
生理盐水、95%(V/V)乙醇、乙醚、蒸馏水
【标本】
抗凝血1ml~2ml/人(练习用)
【操作】
1.准备吸管:将带孔胶乳吸头套在微量吸管上,注意两者连接处应严密不透气。
2.加稀释液:取试管1支,加盐水2ml。
3.持管吸血:
(1)小孔位于胶乳吸头顶端的持管吸血法:右手拇指和中指夹住吸管与吸头交界处,食指盖住吸头小孔,三指轻微用力,排除适量的气体使管内形成负压,将管尖插入抗凝血,三指慢慢松开,准确吸取抗凝血到所需(10/20μl)刻度后抬起食指。
(2)小孔位于胶乳吸头侧面的持管吸血法:右手中指和无名指夹住微量吸管的上端(即近胶乳吸头端),拇指和食指夹住胶乳吸头,拇指盖住吸头侧面的小孔,拇指和食指轻微用力排除适量的气体使管内形成负压,将管尖插入抗凝血中慢慢松开准确吸取抗凝血到所需10μl/20μl刻度后,将管尖离开抗凝血抵在左手无名指上,抬起拇指。
4.拭净余血:用干棉球沿吸管上端向吸管口方向拭净管口余血,如血液超过刻度线,可用干棉球轻轻吸出少许,使其退回到刻度线。
5.释放血液:将吸管插入含有生理盐水的试管底部,慢慢排出吸管内的血液,再用上清液冲洗管内余血2~3次,立即将试管内的液体混匀。
5.洗涤吸管:依次用蒸馏水洗净,95%(V/V)乙醇脱水,乙醚干燥。如为一次性微量吸管,可省略该步骤。
【注意事项】
1.微量吸管插入血液吸血时始终不要离开液面,以免吸入气泡;
2.吸血时要用力适当,不要用力过度,将血液吸入胶乳吸头;
3.若吸血量超过刻度2mm以上,则应更换吸管,以免粘附管壁的血液过多而影响结果。
【方法学评价】
使用微量吸管是手工法血液一般检查的第一步,因为这是手工操作,有很多因素影响检验结果的准确性和精密度,如吸管的质量、操作者的技术熟练程度和责任心等。应用全自动血细胞分析仪时,多需要采静脉血,以克服手工操作的不足。
三、血细胞计数盘的使用
【原理】
一定倍数稀释的血液或体液,混匀后滴入具有固定体积和精密划分刻度的血细胞计数盘中,在显微镜下对所选择区域中的细胞进行计数,再乘以稀释倍数,即可换算成单位体积内的细胞数。
【器材】
改良牛鲍(Neubauer)计数板(血细胞计数板)、盖玻片、显微镜、绸布、微量吸管、试管
改良牛鲍计数板:改良牛鲍计数板由优质玻璃制成,每块计数板由“H”型槽沟分割为两个同样大小的计数池,计数池两侧各有一条支持柱,比计数池平面高出0.10mm,将特制的专用盖玻片覆盖其上,形成高0.10mm的计数池,计数池长、宽各3.0mm,平均分为9个大格,每个大格面积为lmm2,容积为0.lmm3(µl)。在这9个大格中,中央大方格用双线分成25个中方格,每个中方格又用单线分为16个小方格,其中位于正中及四角的5个中方格的是红细胞和血小板计数区。四个角的四个大方格分别用单线分为16中方格,是白细胞计数区。
【试剂】
1.白细胞稀释液 (见毛细血管采血法)
2.红细胞稀释液(见毛细血管采血法)
【标本】
外周血
【操作】
1.准备计数板:用绸布拭净血细胞计数板和盖玻片,采用推压法从计数板下边缘向前平推盖玻片,将其盖在计数池上。
2.稀释血液:取2支小试管,标明A、B,分别加入白细胞稀释液0.38ml和红细胞稀释液2ml,再各加抗凝血20μl、10μl,混匀备用。
3.充池:充分混匀A液,用微量吸管吸取稀释血液滴入计数板和盖玻片交界处,利用虹吸法让液体顺其间隙充满计数池;再取B液,以同样方法在另一侧计数板充池。
4.静置:计数板充池后应平置于桌面上静置2~3min,待细胞下沉。
5.计数:先用低倍镜观察整个计数板的结构(大、中、小方格)及特征,同时观察血细胞分布是否均匀,如严重分布不均,应重新充池。在充A液的计数池观察白细胞计数范围,在充B液的计数池观察红细胞计数范围。
【注意事项】
1.保证计数板和盖玻片清洁。操作中勿让手指接触计数板表面,以防污染,致使充池时产生气泡。
2.一次完成充池,如充池过少、过多或有气泡,应拭净计数板及盖玻片后重新操作。
3.平放计数板,不能在充池后移动盖玻片。
4.计数池内如细胞分布严重不均,应重新充池。计数红细胞用高倍镜,计数白细胞用低倍镜.
5.凡压线的细胞应按照数上不数下、数左不数右的原则.避免漏数或重复计数.注意识别非细胞成分。
6.如使用血液充池,计数板和盖玻片使用后应依次用95%(v/v)乙醇、蒸馏水棉球擦拭,最后用清洁绸布揩净.千万勿用粗糙织物擦拭,以免磨损计数板上的刻度。
7.充池量不可过多或过少,使细胞充分沉淀后再计数。白细胞和红细胞计数一般需沉淀2~3min,血小板应沉淀15~30min,且需注意保湿,因沉淀时间过长会因稀释液挥发造成计数结果不准确。
【方法学评价】
使用血细胞计数板进行细胞计数是临床检验最常用的基本功之一。目前虽有各种自动化分析方法,但该方法由于经典、方便、实用,仍较广泛用于临床检验和科研实践中。
该法产生技术误差的主要因素包括:①微量吸管和计数板的质量。②采血、稀释、混匀、充池等操作是否规范。②计算是否正确。④细胞计数的固有误差随计数数量的增加而减少。
实验二 毛细血管采血、WBC 计数
【目的要求】
1、掌握毛细血管采血的方法,了解不同部位采血对检验结果的影响;
2、掌握显微镜法WBC计数的原理及方法;
3、熟悉 WBC 增高和减少的临床意义。
一、毛细血管采血法
【原理】采血针刺破毛细血管后血液自然流出,用微量吸管吸取一定量的血液。
【器材】一次性消毒采血针、一次性微量吸管、小试管、75%(V/V)乙醇棉球、无菌干棉球。
【试剂】白细胞稀释液
【标本】外周血
【操作】
凡仅需极微量(数滴以内)血液的检验均可用毛细血管采血法。即以刺血针穿剌已消毒的皮肤,使毛细血管血液自然流出,及时采取进行检验。
1.准备:取试管1支,加入白细胞稀释液0.38ml。取一次性微量吸管和乳胶吸头相连,检查连接处是否漏气。
2.按摩:轻轻按摩左手中指或无名指指尖内侧,使局部组织自然充血。
3.消毒:用75%乙醇棉球擦拭采血部位皮肤,待干。
4.针刺:用左手拇指和食指固定采血部位使其皮肤和皮下组织绷紧,右手持一次性消毒采血针自指尖腹内侧迅速刺入,深度2~3mm,立即出针。(竖直进针)
5.拭血:待血液自然流出后,用无菌干棉球擦去第1滴血。
6.吸血:血液自然流出时,用一次性微量吸管吸血至20μl刻度,然后用无菌干棉球压住伤口止血。如血流不畅,可以用左手自采血部位远端向指尖稍施压使血液流出。
7.稀释:用无菌干棉球擦干净微量吸管外部后,将吸管伸入装有白细胞稀释液的试管底部,慢慢排出吸管内的血液,并用上清液冲洗管内余血2~3次,最后将试管内的液体混匀。
【注意事项】
1.所选择采血部位的皮肤应完整,无烧伤、冻疮、发绀、水肿或炎症等,以免影响结果及造成感染扩散。除特殊情况外,不要在耳垂采血。半岁以下婴幼儿由于手指小,可自拇指、脚趾或足跟内、外侧缘采血;严重烧伤者可选皮肤完整处采血。
2.本试验具有创伤性,必须严格按无菌技术操作,防止采血部位感染;做到一人一针一管,避免交叉感染,最好用一次性采血管。
3.皮肤消毒后,应待乙醇挥发后采血,否则流出的血液扩散而不成滴。
4.进出针速度要迅速,且伤口要有足够的深度。
5.因第1滴血混有组织液,应擦去。如血流不畅切勿用力挤压,以免造成组织液混入,影响结果的准确性。
6.在进行多项检查时,采集血液标本的顺序是血小板计数→红细胞计数→血红蛋白测定→白细胞计数与分类。如采血用于自动血液分析仪,最好以优质无菌纸巾擦血,以免棉纤维混人,造成仪器堵孔。
【方法学评价】
血液标本的正确采集是获得正确、可靠实验结果的关键。采集前应仔细考虑实验需要决定采血量。
耳垂血:痛感较轻、适于反复采血,但血循环较差,血细胞容易停滞,常造成结果比静脉血高,且由于严寒、炎热等情况可导致波动较大。
手指血:操作简便,能获得充足量血液,结果较恒定,与静脉血差异较小,但痛感较重,操作不当可导致组织液混入血液,造成检查结果偏低
如要获的更具代表性的血细胞检测结果,静脉采血首选。
二、WBC计数
【原理】用白细胞稀释液将血液稀释一定的倍数,同时破坏溶解红细胞,而白细胞中核蛋白被其凝固变性,仍保留其形态。结晶紫可使白细胞轻微着色而便于识别。
将稀释的血液注入血细胞计数板,在显微镜下计数一定体积内的白细胞数,经换算即可求出每升血液中的白细胞数量。
【器材】显微镜、改良Neubauer计数板、试管、吸管、微量吸管
【试剂】白细胞稀释液:2%冰乙酸溶液中加人10g/L结晶紫(或亚甲蓝)3滴。
【标本】新鲜全血或末梢血
【操作】
1.加稀释液: 用吸管吸取白细胞稀释液0.38ml于小试管中。
2.吸取血液: 用微量吸管吸取新鲜全血或末梢血20μl,擦去管尖外部余血。将吸管插入小试管中白细胞稀释液的底部,轻轻放出血液,并吸取上层白细胞稀释液清洗吸管2~3次。
3.混匀: 将试管中血液与稀释液混匀,待细胞悬液完全变为棕褐色。
4.充池:再次将小试管中的细胞悬液混匀。用一次性Hb吸管吸取细胞悬液1滴,充入改良Neubauer计数板的计数池中,室温静置2~3min,待白细胞完全下沉。
5.计数: 在低倍镜下计数四角4个大方格内的白细胞总数,并记录数据。
6.计算:WBC=[(四个大方格内WBC总数N)/4]×10×20×106=(N/20)×109/L
【结果报告】:
WBC=X.X×109/L
【注意事项】
1.稀释用的吸管、微量吸血管、血细胞计数板均为计量工具,使用前需经过严格的校正,否则将直接影响计数结果的准确。
2.使用标本可为由静脉穿刺采取的新鲜全血,也可为静脉末梢血。采集末梢血时,应注意采血部位不得有冻疮、水肿、发绀、炎症等,以免标本失去代表性;同时也应注意不能过度挤压,以免组织液混人引起血液凝固或造成计数结果不准确。
3.充池时,如充液不足、液体外溢、断续充液,或产生气泡、充液后移动盖玻片等,均会使细胞分布不均匀,造成计数结果不准确。
4.计数池内的细胞分布应均匀,一般情况下各大方格间的细胞数相差不超过10%。若相差太大,应重新充池。
5.计数方格内的压线细胞时,遵循数上不数下、数左不数右的原则。
6.白细胞数量过多时,可采用加大稀释倍数的方法。如20μl血加入到0.78ml稀释液中或10μl血加入到0.38ml稀释液中。
7.白细胞数量过少时,可采用扩大计数域的方法,计数8个或9个大方格;也可采用减少稀释倍数的方法。
8.白细胞稀释液不能破坏有核红细胞,它可使白细胞计数结果偏高,此时应计算白细胞校正值。
【参考范围】
成人 (4-10)× 109/L
新生儿〈 15-20 〉× 109/L
6 月-2 岁(11-12 )× 109/L
实验三 实验四 毛细血管采血、血涂片制备与染色、WBC分类计数
【目的要求】
1、 掌握瑞氏染色原理,方法和影响因素。
2、 熟练掌握血膜制备的要求、技术和注意事项。
3、 掌握显微镜外周血白细胞分类计数的方法
4、 掌握外周血正常和异常白细胞染色后的形态特征,白细胞分类计数;
5、了解白细胞分类的临床意义,
【器材】 光学显微镜、一次性 Hb 吸管、血细胞计数盘、小号试管、载玻片、推片
【试剂】
1.瑞氏染液
① 600ml甲醇 (AR )中含瑞氏染料1.0g,新鲜配制的染料偏碱,需在室温或 37 ℃贮存一定时间,待染料“成熟”一主要是美兰逐渐转变为天青B后才能使用。
②磷酸盐缓冲液(PH6.4-6.8 )
磷酸二氢钾(KH2P04)0.30g,磷酸氢二钠(Na2HP04)0.20g,用少量蒸馏水溶解后,再加蒸馏水至100Oml,配成后用磷酸盐溶液调整 PH。
一、血涂片制备
(一)操作
1. 用血红蛋白吸管吸取已混匀抗凝血少许,置于载玻片的右端约 1/5 处,把推片的一端放在血滴的前方,将推片略向后移,使与血滴相接触,让血滴在推片与载玻片的夹角间散开。
2. 使推片与载玻片间形成 30-45度角,平稳地向前推动至载玻片的另一端,载玻片上留下一薄层血膜。制成的血膜应厚薄适宜,分布均匀,无空泡且不触及边缘,有头体尾之分。
(二)注意事项
1. 滴血量不宜太多,否则容易制成厚片 .
2. 推片与载玻片的夹角为30-45度角,角度越大,推片速度越快,则血膜越厚,反之血膜越薄。
3. 血膜分布不匀有空泡等,主要由于推片不整齐,用力不均匀或太重以及载玻片不清洁所致。
二、血膜染色
(一)原理
瑞氏染料为酸性伊红和碱性美兰组成的复合染料,在甲醇中离解为带正电荷的美蓝(M+)和带负电荷的伊红(E+),血细胞与染料接触,其中带负电荷和正电荷的物质分别与上述染料结合而形成蓝色或红色,中性物质成等电状态,与美蓝和伊红均可结合,形成紫红色。在正常周围血抹片中根据染色特点和形态不同可将白细胞分为几类。由于细胞各种成分均为蛋白质构成,染色时对氢离子浓度十分敏感,故染色必须加入缓冲液。
(二)操作
于血抹片上滴加瑞氏染液 3-5 滴,以染液复盖整个血膜为度,固定1分钟许,滴加约等量的缓冲液与染液混合,再染色10±分钟,用清水冲去染液,待自然干燥即可镜检。
三、WBC分类计数
(一)原理
将血液制成细胞分布均匀的血涂片,用瑞氏染液染色,根据各类细胞的形态特点和颜色差异将白细胞进行分类计数。通常分类100个白细胞,计算得出各种白细胞所占的百分率。
(二)操作
1.将染色风干后的血涂片放于显微镜载物台上。
2.低倍镜观察全片WBC分布、数量和染色情况,选择血膜的体尾交界处,细胞分布均匀、着色良好的区域,滴香柏油1滴。
3.在油镜下按一定顺序呈“弓”字形的移动视野,对所见到的每个WBC进行分类,并用纸按照写“正”或“++++”的方法进行记录,共计数100个WBC。
4.计算出各类白细胞所占比值,以百分比方式报告。(如:N 70% 报告为0.70)
5.各类白细胞所占百分率,乘以白细胞总数,即可求得每升血液中各类白细胞数量的绝对值。
(三)注意事项
1.如发现中性粒细胞有核左移或核右移,应分类计数干状核与分叶核或﹥3分叶核的粒细胞。
2.如血片中发现幼稚细胞或异常WBC时,应分类鉴定,并包括在分类的百分比中。
3.如发现有核红细胞时,应逐个计数但不计入100个WBC内,以分类100个WBC见到幼红细胞多少个来报告,并应注明其所属阶段
4.WBC在(3.0~15.0)×109/L之间者,分类计数100个WBC;WBC在15.0×109/L以上时,应计数200个WBC,低于3.0×109/L时,则应选用2张血涂片计数50~100个WBC。
5.分类中还应注意观察成熟红细胞和血小板的形态、染色及其分布情况,注意有无寄生虫(如疟原虫)及其他异常所见。
实验五 血小板计数、嗜酸性粒细胞计数(示教)
【目的要求】
1、掌握血小板计数的原理、方法、计算、参考范围、注意事项;
2、了解血小板计数的临床意义;
3、掌握嗜酸性粒细胞计数的原理、方法、计算、参考范围、注意事项;
4、了解嗜酸性粒细胞计数的临床意义。
5、熟悉毛细血管采血
一、血小板计数 (目视法〉
【原理】全血作溶解(或不溶解)红细胞但仍能保存血小板完整形态的稀释液稀释后 , 充入血细胞计数盘中,然后于显微镜下进行直接计数,以求得单位体积内的血小板数
【器材】显微镜、改良Neubauer计数板、试管、吸管、微量吸管
【试剂】血小板稀释液:复方尿素稀释液
【标本】末梢血
【操作】
1. 准确吸取稀释液 0.38 ml,置于清洁小试管中。
2. 先让手指温暖充血,常规消毒皮肤,待于后深刺无名指,让血液自然流出,擦去第一滴血。
3. 用巳校准过的血红蛋白吸管一次性准确采血20ul擦净管外血液,轻轻将血加入上述试管底部,并用上清液反复洗吸管三次,立即充分混匀,待完全溶血后再次混匀1min.
4. 取上述均匀的血小板悬液1滴,注入计数池内,静置 10-15min,使血小板下沉。
5. 先在低倍镜下找到中央大方格,再换高倍镜准确辨认,精确计数中央1个大方格(即400 个小方格〉内血小板。
6.计算: 血小板数/升 =1个大方格内所数得血小板数×10×20×106
=1 个大方格内血小板数×0.2×109/L
【结果报告】 PLT=XXX×109/L
【参考范围】〈 100-300 〉X109/l
二、嗜酸性粒细胞直接计数
【原理】要求嗜酸性粒细胞直接计数的稀释液能破坏红细胞和大部分其他白细胞,同时能使嗜酸性粒细胞着色。本实验介绍两种稀释液:溴甲酚紫稀释液和丙酮一伊红稀释液〈Dunger氏稀释液)。因嗜酸性粒细胞的颗粒为非水溶性颗粒,所以在两种稀释液中均不被溶解,溴甲酚紫为指示剂,变色范围为PH5.2-6.8(黄-紫),嗜酸性颗粒在本稀释液中呈现紫兰色,而在丙酮一伊红稀释液则染成红色。取未稍血于稀释液内,然后滴入血细胞计数盘,在显微镜下进行计数。
【器材】显微镜、改良Neubauer计数板、试管、吸管、微量吸管
【试剂】嗜酸性粒细胞稀释液:丙酮一伊红稀释液
【标本】末梢血
【操作】
操作按白细胞计数目视法进行,简述如下:
1.取手指血20ul于已盛有0.38ml稀释液的试管中,立即混匀。
2.待稀释液清亮(或基本清亮)后,取少量充于计数盘两侧的计数池内, 置5分钟左右.在低倍镜下计数两侧中央和四角共十个大方格内的嗜酸性位细胞数。(必要时用高倍镜)
在稀释液中,红细胞已全部被溶解,其他白细胞也基本上被溶解.嗜酸性细胞颗粒在溴甲酚紫液中着兰紫色,在丙酮-伊红液中则染成鲜红色,少数残留的中性粒细胞不着色或着色轻微.如有可疑,可转换高倍镜识别.
3.计算
嗜酸性粒细胞/L=N×106×20=N×20 x109
103
式中N规定范围内数得的嗜酸性粒细胞 .
【结果报告】 Ec=X.XX×109/L
【参考范围】
(O.05-0.5 )× 10/L
【方法学评价 】
嗜酸性粒细胞直接计数稀释液配制方法很多,其基本要求是能溶解红细胞和大多数白细胞,而嗜酸性颗粒能明显着色。一般采用指示剂法和特异性染料着色法 , 本实验介绍的两种稀释液即分别属于这两种方法 , 前者因采用指标剂 , 所以器材均应保持中性 , 否则影响计数结果,后者因丙酮容易挥发,以新鲜配制为宜 ,在4℃保存时间亦不能过长,是为不足之处,且颗粒着色也不如在澳甲盼紫中着色明显易辨 .
三、注意事项
1. 充池前应将红细胞悬液充分混匀。
2. 试管、吸管和计数盘均应无酸、碱或油腻,否则可引起溶血或气泡。
3. 如采血速度过慢 ,血内有凝块 , 则应重取。
4. 计数池内不应有气泡或稀释液外溢现象,如发生上述情况,须重新充池计数。
5. 全部用具和稀释液要特别清洁,防止稀释液或试管中的微细颗粒,微生物等被误认为血小板或血小板聚集而干扰计数 .
6. 血小板容易聚集,在滴入计数室前必须充分摇匀,但摇匀时勿用力太大,以防破坏血小板。
7. 如血液稀释后溶血不完全,可在每 l00ml 复方尿素稀释液中补加尿素 2-4g。
8. 一定要待血小板完全下沉后再计数,计数时可调节光学显微镜的旋钮,仔细辨认。
9. 如用复方尿素稀释液,应在血液稀释后1小时内计数完毕,如用草酸铵液则可在2小时内数完。如放置时间越长,血小板可能越低,在夏季要注意不使液体蒸发,否则血小板失去光泽,不易辨认。
10.为了减少血小板聚集或破坏,应将试管、吸管和注射器硅化后取静脉血计数。
11. 如取血标本同时作白细胞和血小板计数时,针刺应稍深,使血流通畅,拭去第一滴血后,首先采血作血小板测定,操作应迅速,防止血小板聚集和破坏,采取标本后尽快计数,以免影响结果。
12.血液与稀释液接触后,应在半小时内计数完毕,否则嗜酸性粒细胞亦逐渐破碎,使结果偏低。
13.在混匀血液稀释液时,用力不能过大,以免嗜酸性粒细胞破碎。
14.器材必须严格即吸管、试管、计数盘和盖玻片均应干净,洗涤干燥后使用,如溴甲酚紫稀释液滴加于试管内立即变色,应更换并检查原因。
15. 由于正常人嗜酸性粒细胞白天较夜间低,上午比下午波动大,同时受很多生理因素影响,如作动态观察,应固定每天采取标本的时间。
实验六毛细血管采血,RBC计数,HB测定,红细胞形态检查
【目的要求】
1、掌握红细胞计数的原理、方法、计算、参考范围、注意事项;
2、掌握正常和异常红细胞的形态特点及检查方法。
3、熟悉红细胞计数的临床意义。
4、熟悉氰化高铁血红蛋白(HiCN)测定方法和标准曲线的制备。
5、熟悉血红蛋白测定的临床意义。
一、HB测定
【器材】
分光光度计〈或 58 〉G型光电比色计、一次性血红蛋白吸管、一次性采血针、大试管、无菌干棉球和 75% 酒精棉球
【试剂】
一、血红蛋白转化液
Vankampen-Zijlstra 〈文齐氏〉液
K3Fe(CN)6 200mg kCN 5Omg
kH2P04 140mg TritonX-100 1ml
蒸馏水 加至 1000m1
配成的试剂用滤纸过滤后,应为淡黄色透明溶液,置棕色瓶中室温保存备用。
二、 HiCN 参考液
【方法】
氰化高铁血红蛋白〈 HiCN 〉测定法
【原理】
血液在血红蛋白转化液中溶血后,除SHb 外各种血红蛋白均可被高铁氰化钾氧化成高铁血红蛋白〈 Hi 〉,再与 CN- 结合生成稳定的棕红色氰化高铁血红蛋白〈 HiCN 〉。
HiCN最大吸收波峰为540nm,波谷为 504nm,在特定标准条件下,毫摩尔消光系数为44。因此根据待测标本的吸光度,即可求得血红蛋白浓度也(g/l)。
在没有符合标准分光光度计的情况下,亦可用 HiCN 参考液制备标准曲线,或求出换算常数〈 K 值〉,间接计算出血红蛋白浓度。
【操作】
1.绘制 HiCN 的标准曲线
取血红蛋白参考液,表6为例。
表6 HiCN 参考浓度与吸光值〈举例〉
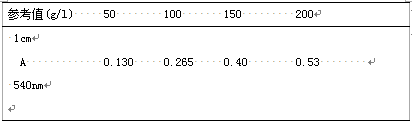
按照表6的数值,以浓度为横坐标,以A值为纵坐标绘图,得一个直线标准曲线.或按下式求出K值。
2. 测定血红蛋白
(l).取手指血20μl,加到5.Oml血红蛋白转化液内,混匀,静置5分钟。
(2).用分光光度计(或 581G 型光电比色计绿色滤光板),光径 lcm,以蒸馏水或转化液作空白调零,测定吸光值"A",然后在标准曲线上查出相应的浓度,或A×K值算出血红蛋白浓度:
入540
Hb(g/l)=A HiCN×64458×251=A×367.7
44 1000
入540
式中:A:测定管吸光值 64458:Hb分子量
HiCN
64458/1000 lmol/L Hb 溶液中含Hb克数 251血液稀释倍数
【参考范围】
男:120-160g/l
女:110-150g/l
新生儿:170-200g/l
【注意事项】
1.血红蛋白转化液中,KCN 为剧毒药品,虽然浓度较低,但在配制时和保存过程中必须提高警惕,防止污染,严禁口吸转化液,
2.比色后废液可按每升加次氯酸钠液〈即安替福民〉约 35ml 混匀,敞开过液,待(CN-)氧化成 CO2和N2挥发后,再排入下水道。
3.血红蛋白转化液不能贮存在塑料瓶中,否则(CN)- 下降,使结果偏低 .
4.对分光光度计的波长、光缝、杂光和比色杯光径,均应校正。
5.标准曲线或K值应定期检查、校正。
6.下列因素可引起血红蛋白假性增高:脂血症,血液浓缩,白细胞 >300OO/ul,儿童症黄症,严重的血管内溶血等。
【方法学评价】
1.HiCN 法操作简便,结果较稳定可靠,为目前公认的测定Hb 的参考方法.但其致命弱点是 KCN剧毒,使用或管理不当可造成严重公害。高白细胞和高球蛋白血症可致混浊,此外,HbCO 转化较慢的问题也未完全解决。
2.测定 Hb 还可用十二烷基硫酸钠( SDS )法,其突出优点是不用剧毒药品,但SDS本身质量差异较大,而且SDS-Hb消光系数和标准液尚待研究。目前还有使用碱化血红索 D575 法者,结果亦甚满意。
3.HiCN 的三种试剂中:文齐氏液的 pH 为 7.2 士 0.2, 血红蛋白在其中转化较快,5 分钟内即可完成。而且加入了非离子表面活性剂,能较好地防止混浊,因而是常用的转化液.都氏液体pH偏高( 8.6 ),血红蛋白完全转化需40分钟,并可产生混浊,所以少用。松原氏液,加入了 NaCl,以增强表面活性剂作用,即可加速溶血,还可防止混浊,但在我国少用。
4.本次实验操作顺序 '
吸取氰化高铁血红蛋白转化液 5ml →吸 HiCN 参考液于转化液中混匀→采末稍血与转化液中混匀→测HiCN参考液的吸光度→计算 K值→测待测 Hb 的吸光度→计算Hb 结果→绘制 HiCN 标准曲线。
5.示教:正常及异常 RBC 形态
二、红细胞计数
【器材】 光学显徽镜、一次性 Hb 吸管、血细胞汁数盘、小试管
【试剂】
甲醛-枸橼酸盐钠溶液
为目前红细胞目视计数法最佳稀释液
枸橼酸三纳 3.0g 抗凝和保持等渗
福尔马林 lml 抗凝和保持等渗
溶于 10Oml 蒸馏水中
【方法】 红细胞计数〈目视法〉
【原理】
用等渗溶液将定量血液稀释到一定倍数〈以达到在计数盘上恰能分清单个红细胞为度〉,滴入血细胞计数池,在高倍镜下计数一定体织的红细胞,根据计数盘的结构原理和稀释倍数,换算成为每升血液中的红细胞数.
【操作】
1.取干燥大试管一只,准确加入红细胞稀释液 2ml
2.按“白细胞计数”采血方法,准确取血10μ1,缓慢放入大试管内混匀,其余操作均与“白细胞计数”目视法相同。
3.将计数盘平放在显微镜的载物台上,用低倍镜找出中央红细胞计数区域。重用高倍镜计数中央大方格中的四个角上和中心的五个中方格内 RBC。
4、计算计数区域RBC的数量
5、计算
红细胞数/L=(N/5)×25×10×103×200
=N×1010=N/100×1012
式中:N 五个中方格内数得的红细胞数 .
×25/5将五个中方格内红细胞数换算为一大方格内红细胞数
×10 1微升稀释血液内红细跑数
×106换算为“/L”
×200为血液稀释倍数(严格的说为201倍)
【参考范围】
男:(4.0-5.5)×1012/L
女:(3.5-5.0)×1012/L
新生儿:(6.0-7.0)×1012/L
【质量考核】
1. 变异百分数评价法
本法适用于 30 人以上集体考核。方法和评价见“白细胞计数“
2. 两差比值评价法
本法适用于个人考核。方法和评价见“白细胞计数”。
【注意事项】:见实验一红细胞计数
1、采血严格按末梢采血要求做。
2、计数按压线和“弓”字要求做。
3、稀释液要过滤、计数板要清洁干燥。
4、如无RBC稀释液,可用新鲜等渗盐水。
5、充池后若每个中方格之间相差超过20个以上时应重新充池。
三、红细胞形态检查
² 小红细胞:小于6um,提示血红蛋白生成障碍,见于缺铁性贫血,珠蛋白生成障碍性贫血,球形红细胞增多症
² 大红细胞:大于10um,为未完全成熟的红细胞,见于巨幼贫,溶贫
² 巨红细胞:大于15um,巨幼贫
² 红细胞大小不均:直径相差一倍以上,见于严重的增生性贫血,巨幼贫
ü 正色素:淡红色圆盘状,中央有生理性浅染区,见于急性失血,再障,白血病
ü 低色素:中央浅染区扩大,甚至成环形红细胞,见于缺铁性贫血,珠蛋白生成障碍性贫血,铁粒幼细胞性贫血。
ü 高色素:染色深,浅染区消失,巨幼贫
ü 多色性:刚脱核,含RNA,提示骨髓红细胞功能活跃,见于溶血或急性失血性贫血。
Ø 球形:红细胞膜缺陷引起的溶血性贫血,中心着色深浓,体积小,有球形之立体感。红细胞骨架蛋白、收缩蛋白缺陷,不能保持正常形态、脆性和可塑性,气体交换功能较正常弱,易破坏、溶解。
Ø 椭圆形:红细胞膜骨架系统缺陷性疾病,椭圆形、杆形,两端钝圆,长轴增大,短轴缩短。红细胞功能异常,脆性增加
Ø 靶形:血红蛋白化学成份发生变异,生存时间仅为正常的一半,见于珠蛋白生成障碍性贫血,
Ø 口形:中心苍白区呈扁平状,膜异常,脆性增加,生存时间缩短。
Ø 镰形:含HbS,在缺氧情况下,溶解度降低,形成长形或尖形结晶体,使膜发生变形,引起溶血,主要见于黑色人种
Ø 棘形:突起间距不规则,见于β脂蛋白缺乏症。
Ø 巨幼细胞性贫血:DNA合成障碍,导致骨髓及外周血红细胞、白细胞、巨核细胞系异常改变,细胞核与质发育不平衡,核落后于质,可发展成全血细胞减少大细胞正色素性贫血。
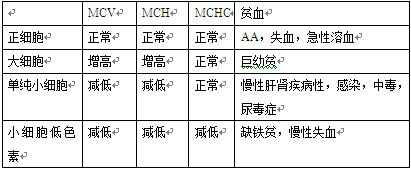
四、红细胞平均指数
实验七 静脉采血,HCT,ESR,RBC三个平均值的测定
【目的要求】
1、掌握静脉采血(collection of venous blood)的方法和无菌操作技术;
2、 掌握红细胞比积测定原理、方法;
3、掌握红细胞三个平均值的计算;
4、熟悉红细胞比积测定和红细胞三个平均值的临床意义;
5、熟练红细胞沉降率的测定的理、方法、注意事项;
6、熟悉红细胞沉降率的临床意义;
7、了解静脉血测定血细胞参数有何优缺点。
一、静脉抽血:
【器材】 一次性消毒注射器、压脉带、垫枕、试管
【试剂】 30g/L碘酊、75%(V/V)乙醇、抗凝剂(109mmol/L枸橼酸钠)
【原理】注射器刺入浅静脉后,负压吸取所需血量。
【操作】
1)准备抗凝管 取试管一支加抗凝剂(109mmol/L枸橼酸钠)0.4ml。
2)检查注射器 左手持针头下座,右手持针筒,使之紧密连接,(针头斜面对准针筒刻度)抽拉针栓检查有无阻塞、漏气、排尽空气,待用。
3)选择静脉 前臂水平伸直置于桌面枕垫上,暴露穿刺部位,选择肘前静脉。
4)消毒 先用30g/L碘酊棉签自所选静脉穿刺处从内向外顺时针方向消毒皮肤,待碘酊挥发后,再用75%乙醇棉签同法拭去碘酊,待干。
5)扎压脉带 采血部位上端扎带(切勿污染消毒部位)
嘱患者反复握拳数次后紧握拳头,使静脉充盈,便于穿刺。
【注意事项】
1)抽血时针栓只能向外抽,切勿向静脉内推,以免注入空气形成气体栓塞,造成严重后果。
2)血液加入抗凝管中后应充分混匀。
3)采血后应立即送检。
二、红细胞沉降率测定
【器材】Westergren 血沉管、血沉架、 试管、吸管
【试剂】 109mmol/L枸橼酸钠溶液:枸橼酸钠(Na3C6H5O7。2H2O)32g,溶于蒸馏水1000ml中。
【标本】 新鲜全血。
【原理】用一定量的枸橼酸钠抗凝血置于特制血沉管中,直立于特制血沉架上,1h后读取红细胞下沉后血浆的高度。
【操作】
1、加抗凝剂 准确吸取109mmol/L枸橼酸钠溶液0.4ml于清洁试管中。
2、采血 准确采取1.6ml,加入抗凝管中立即混匀。
3、装血沉管 用血沉管吸入混匀的全血至刻度“0”处,拭去余血。
4、立血沉管 将血沉管直立于血沉架上。
5、读数 1h末准确读取红细胞下沉后的血浆高度,即为红细胞沉降率。
【注意事项】
1、使用分析纯(AR)枸橼酸钠(Na3C6H5O7。2H2O),配制浓度应准确、液体无沉淀、浑浊,保存期2周。
2、控制抗凝剂与血液比例为1:4。
3、血沉管内径要标准(2.5mm),放置要垂直,不可倾斜。
4、避免直接光照、移动、振动。
5、最宜温度18~25℃,采血后2h内完成。
6、在沉降过程中红细胞沉降率并不是等速下降,因此绝不可只观察30min然后乘以2作为1h血沉结果。
【参考范围】
⑴<50岁: 男0~15mm 女0~20mm/h
⑵>50岁: 男0~20mm/h 女0~30mm/h
⑶>85岁: 男0~30mm/h 女0~42mm/h
⑷儿 童: 0~10mm/h
三、红细胞比容测定
【试剂】 Wintrobe管、细长毛细滴管、离心机。
【试剂】 EDTA-K2分装小试管并干燥 (可抗凝2ml血液)。
【标本】 静脉血。
【原理】 用一定量的抗凝血加于温氏管中,经一定的速度时间离心后,读取压实红细胞层占全血体积的比值。
【操作】
1、采血 静脉采血2ml加入抗凝管中立即混匀。
2、加标本 用细长毛细滴管加入温氏管刻度“10”处(避免气泡)塞紧管口。
3、离心 水平离心机2264g(3000转/分30min,读取压实RBC层柱高mm数,再同样速度离心10min,至RBC 层不再下降为止。
4、观察结果 离心后血液自上而下分为血浆层、PLT层、WBC层和有核RBC层、还原RBC层(紫黑红色)、带氧RBC层。读取RBC层柱高(以紫黑红色层RBC表面为准)的mm数,乘以0.01,即为每升血液中RBC体积的升数。【注意事项】
1、防止血液淤积、浓缩、溶血。
2、上层血浆如有黄疸、溶血应注明,供临床医生参考。
3、离心时间与速度要规范化,否则不宜用于计算MCV、MCHC。
4、本结果主要受RBC数量或血浆容量的影响。
【参考范围】
男性:0.40~0.54 女性:0.37~0.47
四、红细胞三个平均值的测定
【定义】
1、RBC平均容积(MCV):指每个RBC平均体积的大小,以(fl)为单位;
2、RBC平均血红蛋白含量(MCH): 指每个RBC内平均所含血红蛋白的量,以(pg)为单位;
3、 RBC平均血红蛋白浓度(MCHC):指平均每升RBC中所含血红蛋白浓度,以(g/L)为单位。
【计算】
对同一抗凝血标本同时计数RBC、测定Hb和Hct,由此可计算出红细胞三个平均指数。
每升血液中RBC体积(Hct)
⑴MCV=-------------------------------------
每升血液中RBC个数(RBC)
每升血液中血红蛋白含量(Hgb)
⑵ MCH=------------------------------------------
每升血液中RBC个数(RBC)
每升血液中血红蛋白含量(Hgb)
⑶MCHC=------------------------------------------
每升血液中RBC压积(Hct)
【参考范围】
MCV 80----100fl
MCH 27----34pg
MCHC320----360g/L
实验八 临床检验仪器参观、网织红细胞的活体染色技术及形态示教
【目的要求】
1、熟练网织红细胞活体染色和制片技术;
2、掌握网织红细胞活体染色后的的形态特点;
3、熟悉网织红细胞临床意义;
4、了解五分类血细胞分析、干化学尿液分析仪、尿沉渣自动分析仪等现代检验仪器在临床的应用。
5、了解临床检验的仪器工作流程及临床检验的仪器使用与维护情况。
6、了解医院LIS(Laboratory Information System)系统的临床应用
一、网织红细胞计数
【器材】
光学显微镜、一次性采血针、小试管、载玻片、推玻片、Miller 窥盘、一次性 Hb 吸管
【试剂】煌焦油蓝生理盐水溶液
煌焦油蓝 1.0g
枸橼酸钠 0.4g
混匀,溶解后加生理盐水至 l00ml,过滤后贮存于棕色瓶中备用。
【原理】
网织红细胞是晚幼红细胞脱核后到完全成熟红细胞的过渡型细胞。由于其胞浆中尚残存着数量不等的嗜碱性物质 RNA, 经煌焦油蓝活体染色法染色后,可见有蓝色的点状 , 线状或网絮状结构.其网线状物质随着细胞的成熟而逐渐减少以至消失。
【操作】
1.百分计数
①于小试管中滴加1滴煌焦油蓝生理盐水溶液或煌焦油蓝-中性红染液。
②加入末稍血2滴(煌焦油蓝–中性红液加血1滴)于上述试管中,混匀。
③静置,15-2Omin(煌焦油蓝一中性红液是静置37度孵育15min)后,取1滴制成薄片.
④干后,低倍镜下选择细胞分布均匀,着色清晰部分,在油镜下观察并计数 l000个红细胞中网织红细胞数,以百分率或绝对值报告。
⑤ 绝对值计算
网织红细胞数 /ul=网织红细胞%×红细胞数/ul
100
【注意事项】
① 活体染色时间不能过短,室温低时,放37℃温箱
② 最好制片2张,每张计数500个红细胞,避免分布不均引起的误差,涂片要薄而均匀,不使红细胞重叠
③ 如计数方便,可于目镜中放一中间有孔硬纸片,缩小视野,便于计数
④ 试剂应定期重配,以免变质沉淀
⑤ 用瑞氏一姬姆萨染液复染后可使网织忽细胞计数结果减少
⑥ 因操作误差大,不宜用玻片直接染色
⑦ 网织红细胞也可用荧光染色或流式细胞仪计数 .
【参考范围】
成人 0.5%-1.5%
新生儿 3%-6%
绝对值:(24-84)×109/L
2.Miller 窥盘计数法
为了提高计数网织红细胞的精度和速度,ICSH推荐使用Miller窥盘,该窥盘为一厚1mm、直径19mm有圆形玻片,玻片上以微细刻线划分成大小两个正方形,A 为小正方形,B为大正方形,A位于B之内,其中A的边长为B边长的1/3,故其面积为1/9,应用时将 Miller窥盘置于目镜内检测涂片,用小正方形计数红细胞,大正方形计数网织红细胞数,再接下式计算:
网织红细胞 %=B格内网织红细胞 ×100%
A格内红细胞数×9
为了控制CV在10%之内,要求在连续视野中小方格内需要计数的红细胞见表

【报告方式 】
除报告相对值(%)外,还应报告网织红细跑绝对值(个 /L)
3. 网织红细胞生成(成熟)指数(Reticulocyte productionindex,RPI):
有人认为仅用网织红细胞相对值或绝对值表达还不够确切。其贫血时骨髓生成红细胞增多,大量尚未成熟红细胞释放入血,而这些网织红细胞在外周成熟时间需2天,而正常生理情况下骨髓释放到外周的网织红细胞仅一天后其胞质中 RNA即消失。为此 Finch 提出在贫血时用RPI报告,它代表网织红细胞的生成相当于正常人的多少倍。
RPI=网织红细胞相对值(%)×病人红细胞比积
2 45%
“2”为网织红细胞成熟时间(天),又称补正系数, “45”正常人红细胞比积 (% 〉
网织红细胞生成指数的补正系数

二、附院临检科参观
【地点】
临检科住院部实验室
【仪器】
1. Bayer ADVIA 120血细胞分析仪
2. SYSMEX T1800i血细胞分析仪
3. 迈瑞BC2800血细胞分析仪
4. SYSMEXUF100全自动尿沉渣分析仪
5. Diasys2003R/S尿沉渣工作站
一、血细胞分析仪
50年代初期,美国库尔特利用电阻抗原理,设计了血细胞计数仪,使细胞的计数精密度比人工血细胞计数法提高3—5倍,避免了繁重的目力计数,开创了血细胞分析的新纪元。
70年代以后,由于计算机技术的飞速发展,血细胞分析仪进展也很快。不仅血细胞分析仪测量结果的精确性、准确性不断提高,而且检测的参数也逐渐增多,使得医学检验的水平不断提高,为临床提供了更多的有用的实验指标,对于某些疾病的诊断与治疗具有重要的临床意义。另外,仪器还可将RBC、WBC、PLT的分布直方图打印出来,这对正确地分析检测结果及报警原因提供了有用的信息。
近年来,随着各种高新技术在血细胞分析的应用,血细胞分析仪的检测原理不断完善,检测水平不断提高,各种型号的仪器相继问世。
这些仪器主要改进为多项技术联合同时检测一个细胞,综合分析实验数据,得出较为准确的RBC、WBC、PLT、DC、Retic等各项参数结果。
(一)五分类仪白细胞分析原理
1. 容量、电导、光散射(VCS) 法
2. 阻抗与射频技术联合白细胞分类法
3. 光散射与细胞化学技术联合应用
4. 多角度激光法白细胞分类法
(二)过氧化物酶染色分析基础
在五种WBC中,有过氧化物酶活性的细胞按其活性强度依次为E、N、M,而L和B均无此酶。
将血液经过氧化物酶染色后,胞浆内即可出现不同的酶化学反应,由此构成了此种血液分析仪的分析基础。
检测的第一步
血液在仪器内通过分血器进入WBC测试系统,
第一步:将血液加入到含有清洗剂和甲醛的高渗液体内(21倍稀释)并孵育
(40~70℃)20s;
清洗剂:含有非离子表面活性剂,使RBC破坏
甲 醛:使WBC胞质内酶被固定
检测的第二步
发生反应后,即加入过氧化氢(H202)和1-氯-1-萘酚,并加热13s
此时,如果待测细胞质中含有过氧化物酶, 即可分解H202产生[O],后者可使1-氯-1-萘酚显色,并沉积定位于酶反应部位。
检测的第三步
染色后的WBC在通过测试区时,由于酶反应强度不同(阴性、弱阳性、强阳性)和细胞体积大小不同,激光束射到细胞上的前向角(透过光)和散射角(散射光)有所不同;
检测的第四步
以X轴为吸光率(酶反应强度),Y轴为光散射(细胞大小),每个细胞产生两个信号结合定位在细胞图上。
仪器每秒钟可测上千个细胞.计算机对存储的资料进行分析处理,并结合嗜碱细胞/分叶核通道结果计算出白细胞总数和分类计数结果。
(三)嗜碱性粒细胞测量通道
是用于Baso计数和Neut核分叶程度的分析,分析过程中利用“时间差“与RBC/PLT检测使用共同的检测通道。
当血液进入Baso测量通道时,血液与酸性表面活性剂反应,RBC被溶解.除Baso外(因Baso有抵抗活性剂的化学作用) ,其它所有WBC膜均被破坏,胞浆溢出,仅剩裸核。
Baso与其它裸核细胞流入RBC检测系统时,被激光照射后的细胞产生的前向角和散射角变化,产生了二维细胞图。
完整的Baso呈高狭角散射,定位于图的上半部;
裸核位于下半部;
不同的裸核结构不同:如:淋巴细胞、幼稚细胞为圆形,中性分叶核有2叶~5叶及更多叶,在X轴单个核位于左边,分叶越多越靠右边;
计算机根据分叶核/单个核的比例计算出左移指数(1eft index,LI) 。LI越强,说明核左移越明显。
白血病细胞显示在X轴的左侧。
二、尿沉渣自动分析仪
采用计算机技术、电子技术或高科技光学技术结合显微镜或专用设备对尿液中的细胞、管型、结晶、寄生虫、细菌等有形成分进行识别、计数。
(一)镜检法的缺点
1. 费时费力
2. 重复性差
3. 不同检验人员间的差异大
4. 实验室间结果不具可比性
5. 难以标准化
(二)尿沉渣检查的进展
(1)利用干化学法检测尿中白细胞、红细胞;
(2)利用图象摄影系统摄制尿沉渣成分的静止图象,对尿沉渣成分进行自动分类、计算及储存等,形成尿沉渣分析工作站。
(3)利用流式细胞术结合电阻抗原理检测尿中成分进行定量分析的全自动尿沉渣分析仪。
(4)采用干涉、相差、偏振光、扫描及透射电镜等观察。
(5)采用尿沉渣活体染色及细胞化学等多染色法来识别各种细胞和管型。
(6)应用单克隆抗体技术识别各种细胞成分。
1988年:美国-“yellow IRIS”高速摄影机式的尿沉渣自动分析仪,简称Y-1尿自动分析仪。
1990年:对原有的尿沉渣分析仪进行改进,生产出影像流式细胞仪式的UA-1000型和UA-2000型尿沉渣自动分析仪。
1995年:日本东亚公司将流式细胞和电阻抗技术结合起来,生产出新一代的UF-100(fully automated urine cell analyzer)型尿沉渣自动分析仪。
1998年:美国DiaSys公司生产了一种尿沉渣显微镜检查的自动进样装置,它主要由R/S1000主机、清洗箱、自动吸样器、用于光学显微镜观察的涂片收集器等组成,把尿沉渣标本自动吸取到显微镜下的流动计数池进行定量的作用。
(三)UF-100分析原理
1、稀释、染色的标本通过鞘液池
尿液标本被稀释液稀释和染液染色后,靠液压作用通过鞘液流动室,当反应样品从喷嘴出口进入鞘液流动室时,它被鞘液包围,使每个细胞以单个纵列的形式通过流动池的中心(竖直)轴线。
2、氩激光照射
荧光强度(FL) 染色尿液成分发出的荧光主要反映细胞的定量特性;
散射光强度(Fsc) 仪器测定的前向角散射光成比例的反映细胞的大小;
电阻抗的大小电阻抗电信号主要与细胞的体积成正比。
3、测定荧光、散射光和电阻抗
将荧光、散射光和电阻抗的信号转变成电信号,分析这些电信号,得到每个尿液标本产生的直方图和散射图,分析这些图形,即可区别出每个细胞。
(四)检测参数及临床应用
UF-100型全自动尿沉渣分析仪采集标本体积为9ml,自动进样模式所需标本体积不少于4 ml,实际吸取标本体积为0.8ml,检测标本体积为40.0微升,每小时可检测100个尿标本,可报告以下参数:
定量参数:RBC、 WBC、细菌、上皮细胞、管型
提示参数:病理管型、结晶、小园细胞、精子、酵母菌
附加信息:红细胞形态学、导电率
(五)美国DiaSysR/S2003尿沉渣工作站
尿液分析仪对尿样进行干化学分析,尿干化学分析的结果传送到计算机中。再对离心后的尿沉渣用显微镜进行检查,显微镜的图像传送到计算机中,在屏幕上显示出来。
(六)尿沉渣分析仪与显微镜检查
1. 影像式尿沉渣分析仪:
经过严格的定时、定速离心,留取定量的尿沉渣,以标准单位定量报告,因此同手工显微镜方法相比,它的分析标准定量、视野清晰、精确度较高,但许多步骤仍需人为操作,故仍可能存在人为误差。
2. 流式细胞术尿沉渣分析仪优点:
[1] 尿液不需离心,标本用量少;
[2] 检测速度快,每小时可检测100个尿液标本;
[3] 每一标本检测步骤模式一致,易于质量控制和标准化,因而检测精确度较高。
[4] 尿液干化学隐血检验结果和尿液沉渣分析仪红细胞计数的配合能判断出血状况等。
3. 流式细胞术尿沉渣分析仪缺点:
[1] 尿沉渣自动分析仪不能检出滴虫、脂肪滴或药物、结晶等,
[2] 不能鉴别异常细胞,大量细菌、酵母菌还会干扰计数,对影红细胞容易漏诊;
[3] 不能明确病理性管型的分类。
实验九 血常规综合性实验(3学时)
【目的要求】
1、白细胞计数“变异百分率评价”方法。
2、要求在两小时内完成血常规的检测,检测内容包括:白细胞计数、血红蛋白测定、白细胞分类计数。
【原理】用白细胞稀释液将血液稀释一定的倍数,同时破坏溶解红细胞,而白细胞中核蛋白被其凝固变性,仍保留其形态。结晶紫可使白细胞轻微着色而便于识别。将稀释的血液注入血细胞计数板,在显微镜下计数一定体积内的白细胞数,经换算即可求出每升血液中的白细胞数量。
【器材】
显微镜、改良Neubauer计数板、试管、吸管、微量吸管
【试剂】白细胞稀释液:2%冰乙酸溶液中加人10g/L结晶紫(或亚甲蓝)3滴。
【标本】新鲜全血或末梢血
【操作】
1.加稀释液:用吸管吸取白细胞稀释液0.38ml于小试管中。
2.吸取血液:用微量吸管吸取新鲜全血或末梢血20μl,擦去管尖外部余血。将吸管插入小试管中白细胞稀释液的底部,轻轻放出血液,并吸取上层白细胞稀释液清洗吸管2~3次。
3.混匀: 将试管中血液与稀释液混匀,待细胞悬液完全变为棕褐色。
4.充池:再次将小试管中的细胞悬液混匀。用一次性Hb吸管吸取细胞悬液1滴,充入改良Neubauer计数板的计数池中,室温静置2~3min,待白细胞完全下沉。
5.计数: 在低倍镜下计数四角4个大方格内的白细胞总数,并记录数据。
6.计算:WBC=[(四个大方格内WBC总数N)/4]×10×20×106=(N/20)×109/L
7.用计算的结果与仪器法所测结果比较。
【结果报告】:
WBC=X.X×109/L
【注意事项】
1.稀释用的吸管、微量吸血管、血细胞计数板均为计量工具,使用前需经过严格的校正,否则将直接影响计数结果的准确。
2.使用标本可为由静脉穿刺采取的新鲜全血,也可为静脉末梢血。采集末梢血时,应注意采血部位不得有冻疮、水肿、发绀、炎症等,以免标本失去代表性;同时也应注意不能过度挤压,以免组织液混人引起血液凝固或造成计数结果不准确。
3.充池时,如充液不足、液体外溢、断续充液,或产生气泡、充液后移动盖玻片等,均会使细胞分布不均匀,造成计数结果不准确。
4.计数池内的细胞分布应均匀,一般情况下各大方格间的细胞数相差不超过10%。若相差太大,应重新充池。
5.计数方格内的压线细胞时,遵循数上不数下、数左不数右的原则。
6.白细胞数量过多时,可采用加大稀释倍数的方法。如20μl血加入到0.78ml稀释液中或10μl血加入到0.38ml稀释液中。
7.白细胞数量过少时,可采用扩大计数域的方法,计数8个或9个大方格;也可采用减少稀释倍数的方法。
8.白细胞稀释液不能破坏有核红细胞,它可使白细胞计数结果偏高,此时应计算白细胞校正值。
【方法学评价】
手工法
优点:简便易行、不需昂贵仪器,可用于血液分析仪器的校准
缺点:精密度和重复性欠佳
仪器
优点:精密度和准确性较高、易于标准化、适合大规模健康人群普查
缺点:仪器昂贵、某些人为或病理情况(有核RBC、大PLT等)可干扰计数。
【参考范围】
成人 (4-10)× 109/L
新生儿〈 15-20 〉× 109/L
6 月-2 岁(11-12 )× 109/L
【五】 质量考核
1. 集体考核 变异百分率评价法 :V=Xm-X×100
Xm
式中V 变异百分率
Xm 靶值:同一样品多人(30 人以上)计数的均值。
X :被考核者的报告值。
计分 :质量得分 =100-V×2
评价 : 90-100 分为 A 级(优) 80-89 分为 B 级(良)
70-79 分为 C 级(中) 60-69 分为 D 级(及格)
<60 分者为 E 级(不及格)
本法适用于人数较多(如 30 人以上)的技术考核,或市、区集体考核。
2. 个人技术考核 两差比值译价法:“两差比值”即同一标本或同一病人在短时间内两次细胞计数之差与两次细胞计数的标准差之比。
两差比值=(X1-X2)/X1+X2
式中, Xl,X2分别为第一、二次所得细胞数。
质量得分=100-(两差比值×20.1)
根据统计学理论两差比值>1.99, 则两次结果有显著性差异,故失分系数为 40/1.99=20.1
评价标准同异百分率评价法
3. 常规考核标准(routine checkingstandard 简称 RCS)法:本法适用于个人考核
RCS=四大格所见白细胞最大值一最小值×100%
四大格所见自细胞平均值
评价:
WBC≤4×109/L,RCS<30% 合格
WBC(4.1-14.9)×109/L,RCS<20%合格
WBC≥15×109/L者,RCS<15%合格
超过以上标准为不合格
【方法评价】
自视法技术误差主要来源(1)器材不准确、不干净。(2)采血、稀释和混合标本不当。(3)充池失误和计算不准。
另外还有固有误差。该误差可因计数数目增加而减少
实验十 尿液沉渣检查
【目的要求】
1、掌握尿液中各种细胞、管型和结晶的形态特征。
2、掌握尿沉渣镜检的标准化操作。
3、熟悉尿沉渣检验的临床应用。
【原理】 尿液标本经离心沉淀后或不离心尿,置于显微镜下观察其有形成份,如RBC、WBC、上皮细胞、管型及结晶等,协助诊断和鉴别诊断泌尿系统疾病。
【器材】 水平离心机(离心半径15cm)、刻度离心管、载玻片、盖玻片、滴管、光学显微镜
【标本】 新鲜尿液
一.标本采集
1.采集晨尿于清洁干燥一次性尿杯内,1小时内送捡,男性留中段尿,女性应避开月经,清洁外阴后,留取中段尿。
2.尿液标本如不能立即检查,应置冰箱冷藏或按每l00ml尿加入0.5ml甲醛防腐。
二.操作
1.离心尿。
取新鲜混匀的晨尿l0ml于刻度离心管内,用半径15cm的水平离心机以1500r/min离心5min,吸出上清尿,留沉渣量0.2ml。
轻轻混匀沉渣,取0.02ml于置载玻片上,复以盖玻片,或将0.02ml尿沉渣涂成1.8×1.8cm2面积。
先用低倍镜观察细胞、管型等分布情况,再用高倍镜仔细分辨细胞成份,光线不宜太强,太强可使透明管型漏检。细胞在高倍镜视野下至少观察计数10个视野;管型在低倍镜视野下至少观察计数20个视野,得出每个视野的最低至最高值;结晶按高倍镜视野中分布范围估计报告,记录结果。
2.未离心尿
取混匀尿一滴于载玻片上,先低倍镜观察管型,再用高倍镜观察细胞。
三.尿沉渣在镜下的各种有形成份的形态
1. 细胞
包括红细胞、白细胞、上皮细胞、非典型细胞、吞噬细胞等。
⑴红细胞
①典型红细胞:浅黄色双凹圆盘形,多见于泌尿道下段出血。
②皱缩红细胞:表面带刺或锯齿状,颜色转深呈球形。常见于高渗尿,水份从红细胞渗出所致。
③红细胞淡影:血红蛋白从红细胞中脱出,呈大小不等的空环形,称红细胞淡影或影红细胞,多来自肾脏。
镜检时,应将尿沉渣中的红细胞与脂防滴、尿酸盐结品、草酸钙结晶、真菌孢子及酵母菌相鉴别
⑵白细胞/脓细胞
外形完整,无明显退行性变时,胞浆内颗粒清楚可见,胞核清楚,分散存在于尿中;炎症时白细胞增多,有退行性变性,细胞结构模糊,核不清楚,胞浆内颗粒变粗大,细胞常粘成团,称脓细胞;在低渗情况下,中性粒细胞发生肿胀,浆内颗粒呈布郎运动,由于光折射出现“闪光”现象,故将此种细胞称“闪光细胞”,多见于肾孟肾炎。
⑶ 上皮细胞
①扁平上皮细胞:形态扁平而大,不规则、核小、呈圆形或卵圆形。尿道炎时,成片状脱落伴有较多的白细胞。一般来自前尿道或妇女阴道,量少无临床意义。
②大圆上皮细胞:胞体圆形,比扁平上皮细胞稍小,但核略大,呈圆或椭圆形,来自膀胱上皮表层或阴道上皮中层。来自膀胱上皮表层的大圆上皮细胞,可因膀胱的充盈与否,胞体的大小差别较大,充盈脱落的细胞约为WBC的4-5倍,而非充盈状态下脱落的细胞约为WBC的2-8倍,膀胱炎时可成片脱落。
③小圆上皮细胞:胞体较WBC稍大,但一般不超过15um,核大胞浆较少,浆内常见脂肪滴及小空泡,这种细胞在尿中出现时,常示肾小管有病变,亦可来自膀脱移行上反深层,但胞核较小应注意区别。
④尾状上皮:胞体呈拖尾形或彷锤形,长约20-40μm,核较大呈圆形或椭圆形或梨形,来自肾孟、输尿管、膀胱及尿道近膀胱段等处上皮中层。正常人尿中不易见到,在肾盂、输尿管、膀胱颈部有炎症时,可呈片状脱落。
⑷ 非典型细胞
多为退行性变细胞、肾脏和尿路系统的肿瘤细胞,可用巴氏染色法找癌细胞。
⑸吞噬细胞(组织细胞)
胞体比白细胞大2-3倍,圆形、卵圆形或不规则,一个核,常为卵圆形,大而偏位,胞浆中有较多颗粒和吞噬物,常有空泡。
2.管型
①透明管型
无色半透明园柱形,大小长短不一,两边平行,两端纯圆,内部结构均匀,偶有少许细颗粒,因透明度大,需要在弱光下观察,否则易被忽略漏检。
②颗粒管型:分粗颗粒管型和细颗粒管型。
A 粗颗粒管型:透明管型内充满粗大而浓密颗粒,其量超过管型体积的1/3,颗粒由变性细胞来,如吸收色素可呈黄褐色,外形较宽,可有不规则断裂。B 细颗粒管型:透明管型内含有较多的细小而稀疏的颗粒,由粗颗粒碎化而来,其量超过管型的1/3,灰色或微黄色。
③腊样管型
是由细颗粒管型继续碎化而来,是细胞碎解的最后产物,在光学显微镜下形似透明管型,但边缘有切迹呈泡浓样或时有弯曲,无色或淡黄色,外形宽大易折断。
④细胞管型:包括红细胞管型、白细胞管型、上皮细胞管型
A 管型基质内含有红细胞,其量超过管型体积的1/3,红细胞通常多已破碎或完整,称红细胞管型。
B.管型基质内含有白细胞,其量超过管型体积的1/3或充满管型,称白细胞管型,如果白细胞发生变性称脓细胞管型。
C 管型内含有许多肾小管上皮细胞,其量超过管型体积的1/3,细胞体积比白细胞大,称上皮细胞管型。
D 脂肪管型:管型基质内含有多量(超过管型体积的1/3)脂肪滴,脂肪滴大小不等,圆形,折光性强,是肾小管损伤后其上皮细胞发生脂肪变性,并脱落结合于管型中。
⑤肾衰管型
特点是外形宽大而长,不规则、易折断,基质内带有大量颗粒,有时呈扭曲状。是损坏的肾小管上皮细胞碎解后,在明显扩大的集合管内凝集而成。
3.结晶
①磺胶类药物结晶
磺胺噻唑结晶为哑铃状或对称麦杆束状、六角形
黄胺嘧啶结晶为球形辐射状或不对称麦杆束状
黄胺脒结晶为长方薄板状
如结晶不典型时,可加 Ehrlich 醛试剂l滴,出现金黄色者为磺胺结晶。
②酸性尿液中的结晶
③碱性尿液中的结晶
4.其它
乳糜尿时,在沉渣中可找到微丝蚴;阴道毛滴虫时,可在尿沉渣中见到毛滴虫。
四.注意事项
l.尿液标本必须及时镜检,放置过久,细胞和管型都可被溶解。
2.尿内如有大量非晶形尿酸盐或磷酸盐结晶时,可防碍WBC的观察,应特别注意。
3.妇女尿内可混入阴道分泌物内的磷状上皮和WBC等,应取冲洗外阴后的中段尿检查。
4.离心尿中,应固定尿量、离心转速、离心时间和尿沉渣量、检查时的视野数,以便质控。
5.下列物体易被误认为管型,须注意鉴别。
A 粘液丝
透明管状,但多为绵长线形,两边不平行,边缘不清,出现暗淡的长丝纹状,两端尖细卷曲有分支或自身盘旋。
B 类圆柱体
形似透明管型,但有一条尖削的螺旋形尾巴。常与透明管型同时存在,可能是集合产生的粘液丝。
C 假管型
在粘液性纤维状物上粘附有非晶形尿酸盐或磷酸盐而形成的圆柱形,类似颗粒管型,但其边缘不整齐,两端不圆,颗粒粗细不均,加温或加酸后可立即消失,而真管型变性较慢。
D 其它:玻片划痕,纤维丝、毛发等,应与管型相鉴别
五.报告方式
1.管型:离心尿在低倍下20个视野中最低值-最高值
2.细胞成份:离心尿在高倍镜下10个视野中最低值-最高值
3.尿结晶数量:在高倍镜下,以"+"表示,按每占据1/4视野为一个"+",用+-++++表示结晶数量多少
4.寄生虫:查见寄生虫时,可报告找到XXX。如找到滴虫或微丝蚴。
六.参考范围
1.细胞成份RBC:0-3/HP、WBC:0-5/HP,扁平上皮少许(成年女性可多见)大圆上皮偶见/HP
2.透明管型:0-1/LP
3.尿结晶:少许/HP(尿酸、草酸钙或磷酸镁)
七.复习思考题
1.尿中各种细胞、管型各有什么形态,它们是怎样形成的?各有何临床意义?
2.尿中可出现哪些有意义的结晶?其形态怎样?
3.尿沉渣镜检应注意哪些问题?
4.尿沉渣中细胞的多少与尿蛋白质含量是否成正比?为什么?
实验十一 尿液细胞和管型计数
【目的要求】
1、进一步识别和掌握尿沉渣有形成分的形态特征;
2、掌握尿沉渣内细胞和管型的计数方法。
【原理】 通过计数一定时间内尿液中的管型和细胞数量,了解肾脏损害的程度,为诊断泌尿系统疾病提供依据。
【器材】 刻度离心管、细胞计数池、滴管、离心机、显微镜
【标本】 新鲜尿液
一.爱迪氏〈Addis〉计数
测定夜间 12 小时浓缩尿中的管型和细胞数 .
㈠ 标本来集:
1.病人从试验当日早起,正常饮食外,一昼夜内少饮水使尿液浓缩。
2.晚上8时正,病人排尿弃去,留取至次晨8小时正的12小时全部尿液,按l00ml加10%甲醛或麝香草酚0.5ml防腐(开始留尿即加于清洁干燥的容器内),记录尿量。
3.女病人在留尿液时,应先冲洗外阴后再排尿,避免阴道分泌物内的细胞混入尿液内而影响结果。
㈡ 操作:
1.将留取尿液充分混匀后,测定比密,如比密低于1.016者,不作计数。
2.取充分混匀的尿液10ml置刻度离心管以15OOr/min离心10min。
3.用滴管吸去9ml上清液,留1ml充分混匀后,滴加在细胞计数板上,充池。
4.用低倍镜计数10个大方格的管型数,记录之,再用高倍镜计数10个大方格内的细胞数(分别数红细胞数和白细胞数-包括小圆上皮细胞数)并记录之。
㈢ 计算:
N=(1000×C×V)/10=100CV
N:12小时夜尿细胞或管型数
C:计数10个大方格(lul)内的细胞或管型数
V:12小时夜尿的尿量(ml),式中分母10为离心尿液的浓缩倍数
㈣ 参考范围:
透明管型 <5000/12小时夜尿,(相当于常规尿沉渣镜检 0-1个/HP)
红细胞 <50万/12小时夜尿,(相当于常规尿沉渣镜检0-2个/HP)
白细胞 <100万/12小时夜尿,(相当于常规尿沉渣镜检0-5个/HP)
㈤ 注意事项:
如尿液因盐类结晶而混浊,会影响计数,测尿PH,如为酸性尿液,连瓶浸入温水〈不高于37℃〉中片刻,使尿酸盐溶解;如为碱性尿,可加1%醋酸 1-2 滴纠正至刚呈酸性,使磷酸盐结晶消失。
二.1小时细胞排泄率试验
㈠ 标本来集:
病人不必限制饮食,但不能使用利尿剂和过量饮水,准确留取上午(6时30分嘱受试者排空膀脱,留至9时30分)3小时全部尿液,立即检查。
㈡ 操作:
按12小时尿液细胞和管型计数进行操作,分别计数红细胞和白细胞并记录之
㈢ 计算:
N=1000CV/10T=100CV/T
N:每小时细胞排出数
C:10个大方格的红细胞〈白细胞〉数
V:3小时尿量
T:留尿标本经过的小时数
㈣ 参考范围:
红细胞:男<3万/时, 女<4万/时
白细胞:男<7万/时, 女<14万/时
㈤ 复习思考题:
1.试比较爱迪氏沉渣计数和1小时细胞排泄率有哪些不同?各有何优缺点?
2.请分析你作的常规尿沉渣计数结果,说明可能是什么原因?
实验十二 尿液理学、化学实验、尿液分析仪(综合性试验)
【教学内容】
1、尿液理学检查:尿颜色、透明度观察,尿比重测定。
2、尿液试纸条检测方法、影响因素。
3、尿液蛋白质、尿糖等化学实验。
4、尿液妊娠实验。
【目的要求】
1、掌握尿液理学检查和尿液酸度检验;
2、掌握尿蛋白、尿糖、酮体、胆红素、尿胆原等定性检查的方法、原理。
3、熟悉以上检验的方法学评价、临床意义及注意事项。
3、熟悉尿液妊娠实验的方法、临床意义。
【器材】离心机、试管、滴管、吸管(5ml,10ml)、载玻片、显微镜
【试剂】亚硝基铁氰化钠、浓氨水、10g/LBaCL2、Fouchets试剂、对二甲氨基苯甲醛试剂、HCG试带、乙醚 (AR)、 苏丹Ⅲ饱和溶液
【操作】
1.尿酮体检查
(1)lauge法:取新鲜尿20ml于盛有亚硝基铁氰化钠30mg的试管中,震荡使亚硝基铁氰化钠溶解,加乙酸0.5ml混匀,倾斜试管缓慢加入浓氨水1ml于上部,使两液有界面。
(2) 试带法
2.尿胆红素检查
(1)Harrison法:尿5ml+100g/LBaCL22.5ml,离心3~5min,弃上清,加入Fauchets试剂2~3滴观察结果。
(2)试带法
3.尿胆原定性试验
(1)改良Ehrlich法:含胆红素:尿︰BaCL2=4︰1,2000r/min离心5min,除去胆红素,取上清液试验。不含胆红素:尿3ml+试剂0.3ml,室温静置10min,观察结果。
(2)试带法
4.乳糜尿检查:乙醚萃取试验
5.尿HCG检查:试带法
实验十三 大便常规,隐血,精液常规检查
【教学内容】
1、大便理学检查:颜色、性状观察。
2、大便的隐血实验及显微镜检查。
3、精液常规检验。
【目的要求】
1、掌握粪便理学检查、化学检查;
2、能识别粪便内各种物体的形态特征和报告方式;
3、掌握精液常规检验项目的内容、方法及临床意义;
一、大便常规、隐血实验
【器材】
显微镜、试管、干锅、载玻片、血红蛋白吸管、血细胞计数盘、恒温水浴箱
【试剂】
饱和石炭酸、生理盐水、冰醋酸、
10g
/L邻联甲苯胺溶液、3%H2O2、
30g
/L匹拉米同乙醇液、隐血试剂条。
【操作】
1、大便常规检查
1)标本采集
2)理学检查:颜色、性状
3)显微镜检查:涂片制作,低倍镜观察,高倍镜观察
报告方式:大便颜色、性状
镜检:①未发现异常成份:可报告无异常发现
②发现异常成份:报告方式:××虫卵× ~××个/LP
2、粪便化学检查
1)隐血试验
①匹拉米同乙醇1滴+冰醋酸1滴+3%H2O21滴,不显色,竹签挑取粪便,观察颜色变化。
②无色雀绿法。 ③邻联甲苯胺法。④肌红蛋白试验原理。
2)粪胆素试验:取黄豆大小的粪便+饱和氯化汞溶液4ml与粪便调匀。
二、精液常规检查
【器材】
光学显微镜、恒温水浴箱、中小号试管、Hb吸管,血细胞计数盘
【试剂】
1、精子稀释液:
NaHC03 5.Og+40%甲醛lml+蒸馏水至l00ml
2、生理盐水。
【操作】
(一) 标本采集:
1、标本采集的时机:在采集精液标本前,必须禁欲3-5天,一般不超过5天。禁欲时间太长,精液量增加,而精子活力下降。以手淫法或体外排精法病人自己采集送检。不能排精病人用前列腺按摸法、电子震动法采集、避孕套法因其含有对精子有害的物质,可杀死精子或影响精子的活力,不主张用此法。
2、不论用什么方法采集标本,都应将精液全部收集子清洁干燥的大口容器内,应于30分钟内送检,冬季保温送检。因精子生成数目日间变化较大,不能依据一次检测结果做出诊断,一般应间隔1-2周检查一次,连续检查2-3次。
(二) 理学检查:
l、量:正常人精液量为2-5ml,小于1ml或大于8ml都不正常。
精浆是精子活动的介质,可中和阴道的酸性分泌物,提供精子的生存环境。精液量减少,不利于精子通过阴道进入子宫和输卵管,影响受精。见于前列腺和精囊病变,射精管阻塞,先天性精囊缺如。精液量增多,精子被稀释,也可致不育。雄激素水平升高所致。
2、颜色:正常人精液为灰白色或乳白色,久未射精者(10天以上)可略带黄色。
红色:血性精液,见于生殖系统炎症,结核和肿瘤等。
黄色或棕色:浓性精液,见于精囊炎和前列腺炎。
3、精液液化时间:
精液液化:指排精后,精液从胶冻状转变为流动状的过程,观察液化时间,标本应放37℃,每10分钟观察一次。精液离体后5-10分钟开始液化,通常30分钟液化完全。
超过1h仍不液化或液化不完全属于异常,可抑制精子活力,减少受孕机会。
24小时精液不液化,则不作能显微镜检查,直接报告“24小时不液化”。
4、精液的酸碱度:精液pH测定应在射精后1h内完成,用精密pH试纸测定,正常为PH7.2-7.8。
pH<7.0,伴少精,常反应输精管阻塞或先天性精囊缺如;pH>7.8,见于急性前列腺炎、精囊炎、附睾炎。
(三)显微镜检查:
取已液化的精液于洁净载玻片上,加18×18mm盖玻片,先以低倍镜检查有无精子,如无精子则将精液离心后取沉淀涂片检查,仍不见精子,即报告为无精子,其他试验均可不做,这是男性不育的主要原因,如有再作以下检查。
1、精子存活率:
在镜下计数100个精子,分活精子与不活动的精予求出活动精子活动率〈湿片检查如室温低于 10 ℃时 , 应放 37 ℃ 5~10 分钟后镜检 ).
活动精子存活率 = 活动精子数
活动精子数 + 不活动精子数
正常精液活动精子在排精后 30~60 分钟内就有 80~90%, 至少应大于 60%, 排精后 90~181 分钟内, 保温条件下应有 50% 以上的活动精子。
2 、精子活动能力
此项是检查精子活动的质量 , 即精子活动强度可分五级报告 .
①、0 级 : 为死精子 , 有精子的形态但无活动 , 加温后仍不活动 .
②、I 级 : 活动不良,精子运动迟缓 , 原地打转 , 摇动或抖动
③、Ⅱ级 :活动尚可 , 慢速移动 , 方向不定 , 不呈直线运动 , 常带回旋。
④、 Ⅲ 级 : 运动中速 , 呈直线运动。
⑤、Ⅳ级 : 活动良好 , 为快速直线活动 , 很快通过一个视野 .
正常精子活动力在Ⅲ 级以上 ,o 级和 I 级精子 >40%以上为男性不育症的原因之一 .
3 、精子形态 :
在检查精子活动力的涂片上直接观察计数 100 个精子中形态异常的精子数,亦可经染色后观察:
①、正常精子形态 : 分头、颈〈体〉、尾三部分 , 形如蝌蚪状 , 头长 3~5um 、宽 2~3um,精予全长约 50~60m.
②、异常精子形态:分头部异常、体部异常和尾异常 .
头部异常有:大头、小头、尖 头、双头、梨状头、无定型头及头部边缘不齐。
体部异常有 : 分枝、双体、体部肿胀或无体部。
尾部异常有 :双尾、卷曲尾、短尾、无尾。
正常精液中 : 异常精子应<10~15%,>20% 为不正常。
4 、细胞:
正常精液中 , 红细胞。 0~1/PH白细胞 <5/PH, 上皮细胞和精原细胞 0~1/PH,查到上述细胞应如数报告 .
5 、精子计数
〈 1 〉、原理 :利用重碳酸钠分解粘液的作用来破坏精液稠性 , 甲醛固定精子 , 然后稀释计数 .
〈 2 〉、操作
①、取 精子稀释液 0.38ml 十已液化混匀精液 0.02ml 〈血红蛋白吸管取 ) 混匀 ,
滴加血细胞计数板 , 静置 3 分钟 .
②用高倍镜计数中央大方 格内 5 个中方格的精子数 , 乘以 109即为每升精液中的精子数 .
〈 3 〉计算公式 :精子数 /L= 5中方格精子数× 5×lO × 2O×106
一次排精子 总数 = 精子数 /L×精液量〈ml 〉
1000
正常精液精子数/L为 (60~1O0)×109
至孕的低限为 2O×l09/L
一次排精精子总数为( 4"~6 ) ×l08
6、其他:如发现有结晶体、磷脂体、淀粉样体等如实报告
实验十四 阴道分泌物常规检验及染色
【目的要求】
1、掌握阴道清洁度检查。
2、掌握阴道分泌物的涂片制备方法。
3、掌握革兰染色方法。
4、掌握阴道分泌物涂片染色中的各种有形成分的形态。
【器材】
光学显微镜、玻片
【试剂】
生理盐水、革氏染液
【操作】
(一)、标本采集
用消毒棉签自阴道后穹隆部采集分泌物,浸入盛有生理盐水1-2ml的试管内,立即送检
(二)、显微镜检查
用阴道分泌物生理盐水混合物混匀涂片作清洁度检查 , 滴虫检查、霉菌检查和细菌检查 .
1 、清洁度检查:
用高倍镜观察涂片上的上皮细胞、白细胞 ( 脓球 ) 、杆菌球菌的多少 , 划分清楚 , 见下表 :
阴道分泌物清洁度判断
清洁度 杆菌 球菌上 皮细胞 白细胞或脓细胞
Ⅰ ++++ - ++++ O~5/HP
Ⅱ ++ - ++ 5~15/HP
Ⅲ - ++ - 15~30/HP
Ⅳ - ++++ - >30/HP
2 、滴虫检查 :
冬天应将采集的标本保温送检 , 在涂片上先用低倍镜寻找比白细胞大能活动的物体,如见到有运动的比白细胞大的物体时 , 转高倍镜观察鉴别滴虫为一梨形透明白色小体 , 有波动膜和鞭毛。
报告方式 :( 未〉找到滴虫。
3 、霉菌检查:
在阴道分泌物涂片上加 1 滴 100g/L 氢氧化纳溶液 1 滴混匀, 先用低倍镜寻找菌丝样物 ,若有菌丝样物时 , 转高倍镜鉴别确为菌丝及孢子〈有时不见孢子〉为霉菌 .
报告方式: 〈未〉找到霉菌。
4 、细菌 :
将涂片用革兰氏染色后找有关病原体 , 如革兰氏阴性双球菌 , 应考虑淋病双球菌 , 其它革兰氏阴性杆菌、阳性杆菌、阳性球菌均为杂菌 , 可依据其数量作报告 .报告方式 : 找到 革兰氏染 色阴性〈阳性 〉球〈杆菌〉 .
实验十五 浆膜腔积液的检验(含细胞染色分类)
【目的要求】
1、掌握浆膜腔积液的常用检验项目的内容、原理及方法;
2、了解浆膜腔积液涂片细胞染色检验方法和各种细胞形态;
【器材】
比密计或折射仪、 光学显微镜、 100ml量筒、小号试管、 Hb吸管、血细胞计数盘、
【试剂】
100g/LEDTA钠盐、 冰醋酸。
【操作】
1、标本采集:无菌穿刺术采集、分装于两支无菌试管内。一支加100g/LEDTANa20.15ml,另一支不加抗凝剂,用以观察凝固现象。
2、理学检查
1)颜色。2)透明度。3)凝固性。4)比密:用比密计或折射仪测定比密。比密<1.018为漏出液,比密度>1.018为渗出液。
3、化学检查
1)李凡他试验:浆液粘蛋白试验
操作:在100mldH2O中加入冰醋酸2~3滴,加入穿刺液1滴,出现白色混浊为阳性,无明显现象为阴性。
4、显微镜计数
1).细胞总计数
2).WBC计数
3).WBC分类计数
5、将穿刺液离心后用沉渣涂片作瑞氏染色,作细胞分类,至少应数100个WBC。